Kort forklaring
Et atom er den mindste bestanddel af et kemisk element. Det består af en kerne af positivt ladede protoner, eventuelt med nogle neutrale neutroner, og er omgivet af en sky af negativt ladede elektroner.
Antallet af protoner bestemmer hvilket grundstof det er. For eksempel har brint én proton, ilt har otte protoner, og uran har 92 protoner.
Atomets historie
Det udelelige
Ideen om atomet opstod allerede for to et halvt årtusinde siden, da grækeren Demokrit stillede spørgsmålet, "Hvor mange gange kan man dele en sten i to?" (eller en gren, eller et sandkorn, eller noget andet, alt efter hvilken kilde man vægter højest).
Demokrit forestillede sig, at man til sidst måtte komme til en mindste del, som ikke kunne deles, og han kaldte denne grænse for et "atom", der på græsk betyder "udelelig". Han og hans efterfølgende tilhængere af "atomismen" forestille sig endda flere forskellige atomer, med forskellige egenskaber: Jernatomer var stærke og med kroge så de kunne holde fast i hinanden, saltatomer var spidse og skarpe, vandatomer var glatte, luftatomer var lette, osv.
Filosofi bliver til videnskab
Selvom denne formodning lægger sig ret tæt op ad den moderne teori, havde hverken Demokrit eller andre videnskabsfolk de næste par tusinde år dog nogen mulighed for at teste den. I løbet af den sidste halvdel af 1600-tallet opstod med den anglo-irske videnskabsmand Robert Boyle en mere videnskabelig tilgang til at undersøge kemiske stoffers beskaffenhed, og det begyndte at gå op for videnskabsfolkene, at der var noget om snakken. I 1789 udgav den franske kemiker Antoine Lavoisier en liste over 33 elementer (som dog inkluderede "lys" og "kalorik", et element man mente udgjorde varme), og i starten af 1800-tallet viste englænderen John Dalton, hvordan visse stoffer var bygget op af andre i nogle helt bestemte masseforhold, som måtte have at gøre med, hvordan stoffernes byggesten satte sig sammen.
Dalton byggede videre på ideen om, at elementerne bestod af ikke-reducerbare enheder — atomer — og han beregnede, hvor meget forskellige elementer, eller grundstoffer, vejede; ikke i gram eller kilo, da han godt kunne se, at atomerne måtte være så små at man ikke kunne veje de enkelte, men i termer af det letteste grundstof, hydrogen (også kendt som brint). Altså, hvis vi definerer hydrogen til at veje "1", så vejer kulstof "12", ilt "16", osv.
Flere grundstoffer blev opdaget, og i slutningen af 1860'erne kunne den russiske kemiker Dmitri Mendeleev fremvise den berømte perodiske tabel, hvor han viste at grundstofferne kunne listes efter deres atommasse og opdeles i rækker ("perioder") og søjler, og på denne relativt simple måde gruppere dem efter deres kemiske egenskaber.
Demokrit skulle efter sigende være ualmindelig lattermild, hvorfor de fleste gengivelser af ham viser ham grinende.
Kredit: Düsseldorf Philosophische Fakultät.
Men hvor mange gange kan man så dele en gren over i to, før man når ned til det sidste atom? Klik her for svaret, men prøv at gætte først. Svaret vil måske overraske dig.
Atomets bestanddele (og mere historie)
Omkring år 1900 gik det op for forskerne at atomet alligevel ikke var udeleligt, men bestod af subatomare partikler:
Elektronen
I 1897 fandt den britiske fysiker J. J. Thomson en partikel, som vejede ca. 1800 gange mindre end hydrogen, og som man hurtigt fandt ud af var den samme partikel, der bar elektrisk strøm i ledninger. Han kaldte partiklen for en "korpuskel", men den blev senere omdøbt til elektron. Thomson forestillede sig atomet som en positivt ladet "plumbudding" fyldt med negativt ladede elektroner.
Atomkernen
Ernest Rutherford var en engelsk atomfysiker, som i 1908 fik Nobelprisen i kemi for sit arbejde med radioaktivitet. Som om det ikke var nok, lavede han året efter et eksperiment der (efter et par års grublen) fik ham til at påstå at atomet, nærmere end at være en budding af positiv og negativ ladning, har en positiv og meget kompakt kerne:
Når Rutherford skød heliumkerner igennem et tyndt guldfolie, røg de for det meste lige igennem, men en gang imellem røg de tilbage i den retning de kom fra. Som han udtrykte det: "Det var det mest utrolige, der nogensinde er sket i mit liv. Næste lige så utroligt, som hvis du havde skudt en 15-tommers granat mod en serviet, og den kom tilbage og ramte dig."
Protonen
Rutherford var ikke færdig med at skyde med heliumkerner, og i 1919 viste han, at når han skød dem ind i luft, blev der udsendt hydrogenkerner (især fra luftens nitrogen), som han døbte protoner. Protonens eksistens havde været mistænkt i 100 år, men det gik nu op for forskerne, at dét der afgjorde, hvilket grundstof et atom var, var antallet af protoner i dets kerne.
Hydrogen havde én proton, helium havde to, kulstof havde seks, ilt havde otte, osv.
Neutronen
For ikke at frastødningen fra de positive protoner skulle få dem til at flyve fra hinanden, påstod Rutherford at der måtte være nogle andre partikler i kernen som var neutralt ladede, og på en eller anden måde holdt sammen på kernen. Der skulle dog gå nogle år før den engelske fysiker James Chadwick påviste denne partikel i 1932. På dette tidspunkt havde den allerede fået sit navn, neutronen, af den amerikanske kemiker W. D. Harkins i 1921.
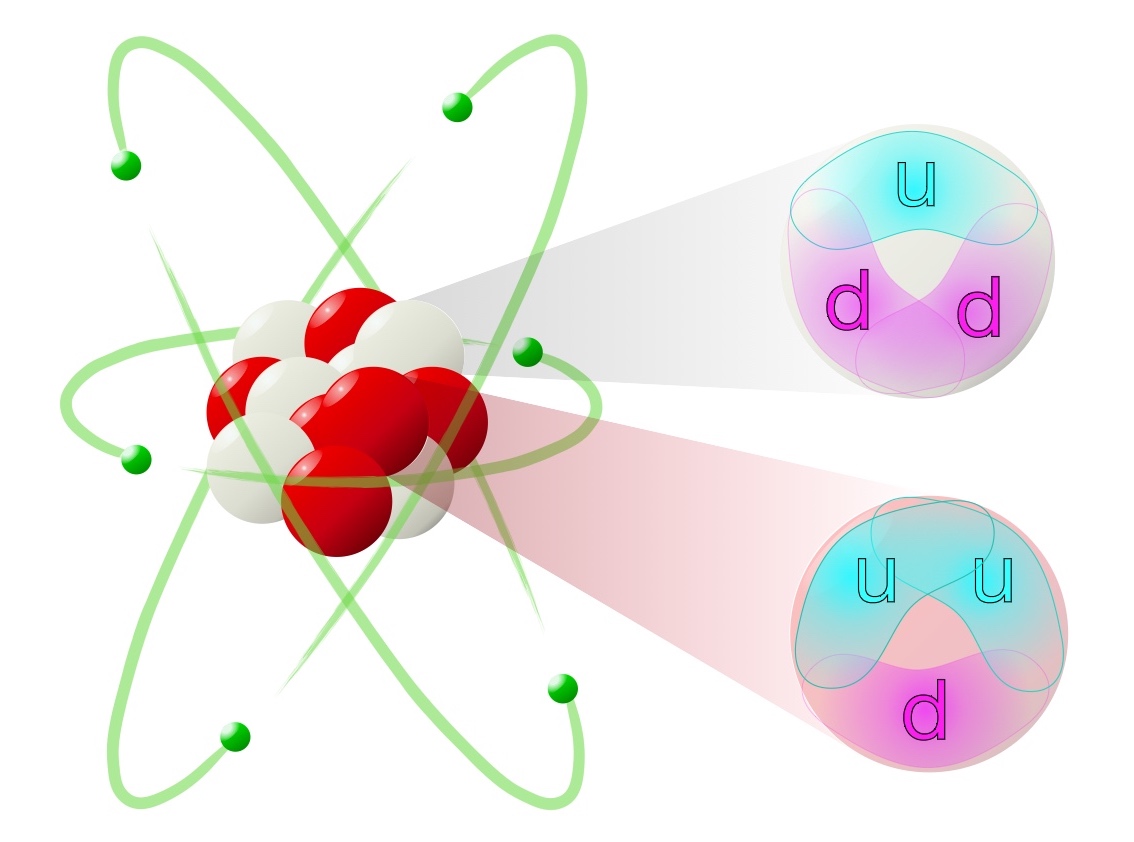
Kvarker
Elektronen er, så vidt vi ved, en ægte elementarpartikel — den er udelelig, og har ingen indre struktur. Ved hjælp af bl.a. partikelacceleratorer fandt man derimod i 1960'erne ud af, at protonen og neutronen begge er bygget op af mindre partikler, som fik navnet kvarker. Navnet fandt den amerikanske fysiker Murray Gell-Mann på, oprindelig mest bare som en lyd. Stavemåden kom senere, da han stødte på sætningen "Three quarks for Muster Mark" under "én af hans lejlighedsvise gennemlæsninger af James Joyces Finnegans Wake", en udtalelse som burde være nok til at fratage ham den Nobelpris han fik i 1969 🙄
Begge partikler består af tre kvarker: Neutronen består én "op"-kvark (cyan; "u"), som har ladningen +⅔ og to "ned"-kvarker (magenta; "d"), som har ladningen –⅓, og derfor er neutronens ladning +⅔ – ⅓ – ⅓ = 0, altså neutral. Protonen består to op-kvarker og én ned-kvarker, og derfor er dens ladning +⅔ + ⅔ – ⅓ = 1, altså positiv.
Omkring atomets kerne svæver/kredser/chiller ud/eksisterer et antal elektroner (grønne) i forskellige baner/orbitaler/tilstande. Normalt (hvadend dét betyder) vil der være lige så mange elektroner som der er protoner, sådan at atomet samlet set er neutralt, og de vil befinde sig i de lavest mulige energitilstande.
Kredit: Peter Laursen.
Atommodeller
Fysikere og andre videnskabsfolk kan godt lide at bygge modeller af naturen. En "fysisk model" er ikke fysisk i den forstand, at den er bygget i pap og papir, men er et sæt af fysiske sammenhænge, som ikke er (alt for meget) i modstrid med accepteret videnskab, og som kan forklare en række egenskaber ved nogle fænomener indenfor et afgrænset område. En fysisk model af et atom skal altså kunne forklare, hvorfor atomet opfører sig som det gør. Den skal ikke forklare, hvorfor Jorden bevæger sig rundt om Solen, men skal trods alt heller ikke ligefrem være i modstrid med tyngdeloven.
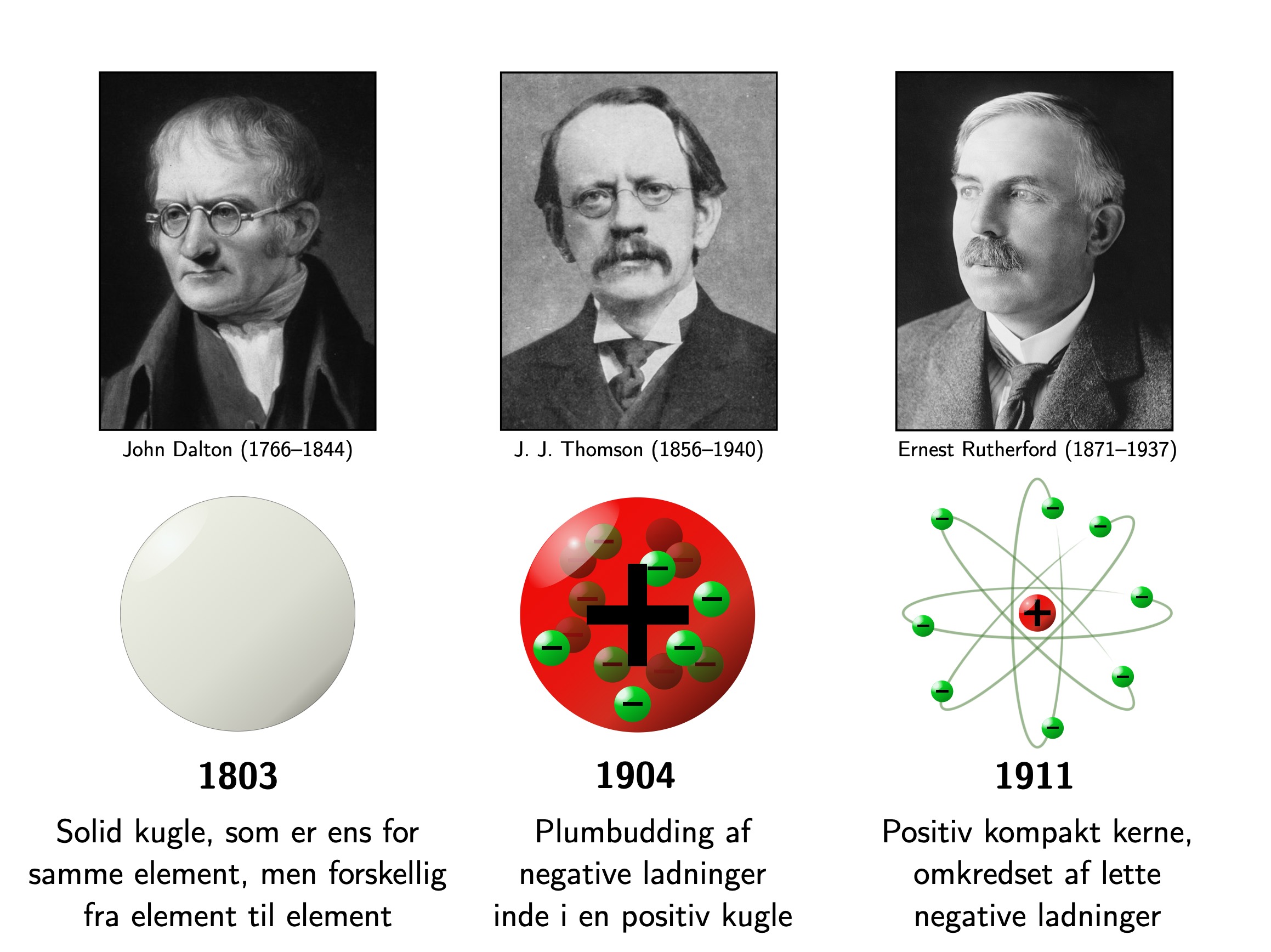
Daltons, Thomsons og Rutherfords modeller
Vi har allerede stiftet bekendskab med nogle modeller ovenfor: Daltons atom var en udelelig kugle, mens Thomsons atom var en positiv kugle fyldt med negative elektroner. I Rutherfords model var atomet mest tomrum, med protonerne samlet i en kompakt kerne, og elektronerne flyvende rundt udenom.
Men samtidig med, at atomets struktur blev kortlagt, opstod også bevidstheden om, at partikler på atomart niveau opførte sig markant anderledes end man var vandt til fra klassisk mekanik. Atomer kan udsende og absorbere lys — eller fotoner — med forskellige bølgelængder, og dermed forskellige energier. Men efterhånden gik det op for forskerne, at fotoner udsendt fra atomer kun kunne have nogle helt bestemte energier. De var kvantiserede.
Kredit: Peter Laursen (fotografier fra Wikimedia; Dalton/ Thomson/ Rutherford).
Bohr-modellen
Denne erkendelse ledte til en af fysikkens absolut største paradigmeskift; kvantemekanikken. I denne teori giver det mening, hvorfor et atom overhovedet kunne være stabilt og ikke kollapse: Man vidste, at ladede partikler som accelereres, udsender lys. Men hvis elektronerne er i kredsløb om kernen, ændrer de konstant retning og er dermed i acceleration. Hvis de opførte sig "klassisk", burde de hele tiden udsende lys, og dermed miste energi så hurtigt, at elektronerne på et splitsekund ville spirallere ind i kernen.
Det blev den danske fysiker Niels Bohr, som kom med en forklaring på dette: I 1913 fremviste han en model, hvor elektroner nok kredsede om atomets kerne, men kun i helt bestemte baner, med helt bestemte energier. Modellen minder på mange måder — også matematisk — om planeternes kredsen om Solen, men hvor planeter i princippet ville kunne kredse hvor de vil, er elektronerne begrænset til at ligge i bestemte afstande fra kernen. Specielt er der en mindste bane, kaldet "grundtilstanden".
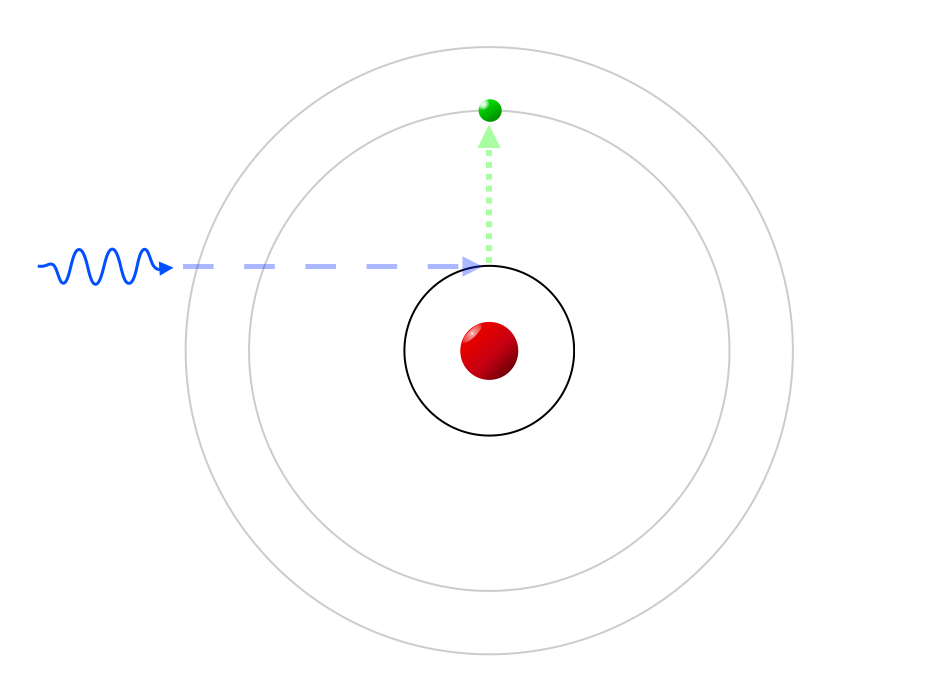
Jo større radius banen har, jo mere energi har elektronen. Hvis en foton kommer for tæt på atomet, bliver den absorberet og ophører med at eksistere. Fotonens energi forsvinder dog ikke bare, men bliver brugt til at sparke en elektron ud i en mere energirig tilstand, hvor den så ligger og er "exciteret", eller "anslået". Forskellen i energi mellem tilstanden før fotonen blev absorberet, og tilstanden efter, er præcis dén energi, som fotonen havde.
Men det skøre ved kvantemekanikken (eller rettere, én af de utallige skøre konsekvenser af kvantemekanikken) er, at hvis fotonen der kommer flyvende har lidt for lidt, eller lidt for meget energi, så bliver elektronen ikke bare sparket ud i en lidt mindre, eller lidt større, bane. Atomet er kvantiseret, og den slags småændringer er simpelthen forbudt! Hvis ikke fotonens energi passer (næsten) præcis til energiforskellen mellem to baner, vil den flyve lige igennem atomet.
En meget energirig foton kan dog rive elektronen helt væk fra kernen, sådan at atomet bliver ioniseret.
Kredit: Peter Laursen.
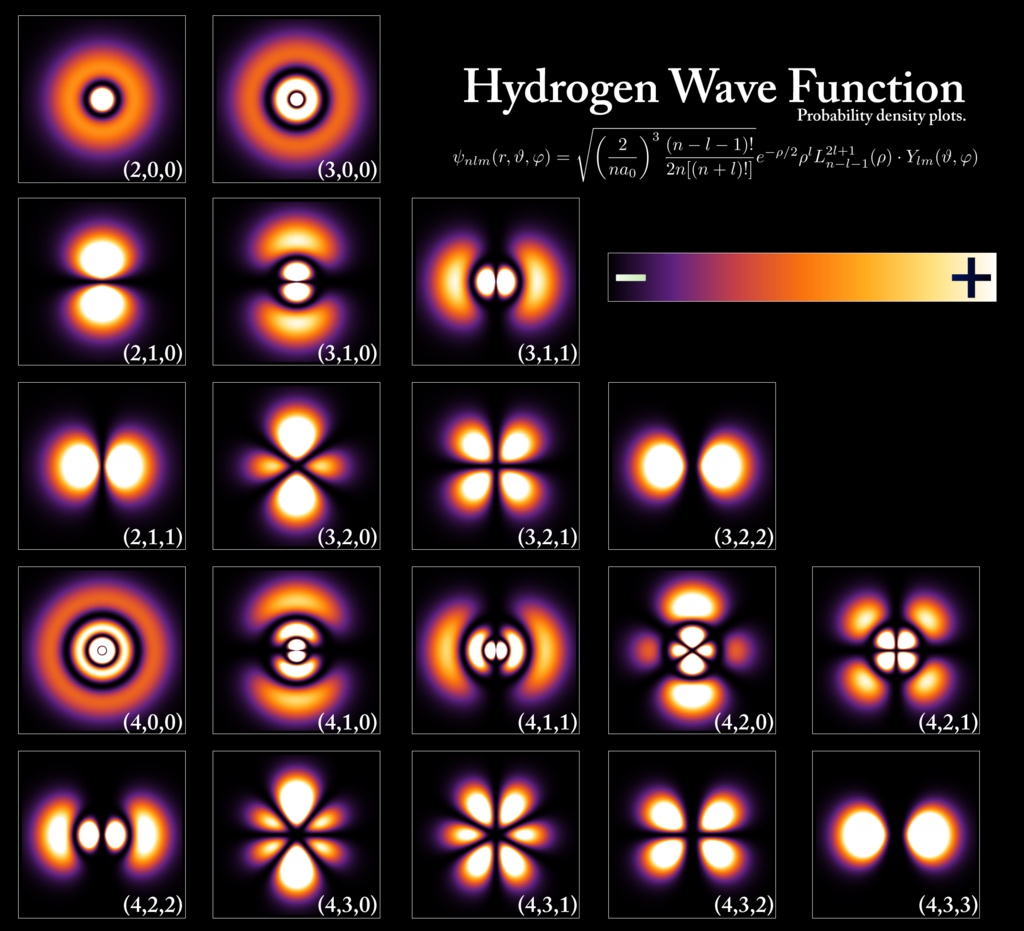
Schrödingers model
Bohrs atommodel var en fantastisk erkendelse, og har ledt til en dyb forståelse af atomfysikken. Som de foregående modeller har den dog alligevel sine begrænsninger. Ret hurtigt gik det op for fysikerne, at selvom det giver mening at forestille sig atomet som et lille (omend kvantiseret) planetsystem, er det en vigtig konsekvens af kvantemekanikken, at man ikke må forestille sig elektronen — eller nogen andre partikler, for den sags skyld — som værende lokaliseret et bestemt sted i rummet på et givet tidspunkt.
Bohrs model og andre kvantemekaniske modeller led under at være en blanding af indsigtsfulde postulater og eksperimentelle resultater, som man ikke helt forstod. Ligningerne var fænomenologiske mere end egentlig teoretiske, og de indeholder ofte nogle mere eller mindre velforståede korrektionsfaktorer. Overgangen fra "den gamle" til "den nye" kvantemekanik skete, da den tyske fysiker Werner Heisenberg i 1925 "startede forfra" og formulerede kvantemekanikken vha. såkaldte "matricer", hvor sådan noget som hastighed og position ikke bare var ét tal, men rækker og søjler af flere tal, oven i købet såkaldte "komplekse" tal.
Året før havde den franske fysiker Louis de Broglie postuleret, at alle partikler skal opfattes som en mellemting mellem partikler, som er ét sted, og bølger, som er mere udbredt i rummet. Denne ide brugte den østrigske fysiker Erwin Schrödinger til formulere en matematisk model for atomet:
Nærmere end distinkte baner må elektronen forestilles at udgøre en form for udflydende "sky" omkring atomets kerne. Denne sky beskrives matematisk med en såkaldt bølgefunktion og som mange andre aspekter af kvantemekanikken har den været genstand for dybe filosofiske diskussioner mellem fysikere. Ér elektronen et sted, som vi bare ikke ved, men med størst sandsynlighed der hvor bølgefunktionen har en høj værdi? Eller er elektronen i virkeligheden over det hele, men "mest" der hvor bølgefunktionen har en høj værdi?
Kredit: PoorLeno/Wikimedia Commons
Kvantefeltteori
Schrödingers model er sådan set stadig den fremherskende model, men formuleres i dag i en større sammenhæng i det der kaldes kvantefeltteori; en model som kombinerer kvantemekanik og (speciel) relativitetsteori. I denne teori er partikler hverken partikler eller bølger, men en slags "forstyrrelser" i hver deres underliggende "felt". Et felt er en fysisk størrelse, som matematisk har ét eller flere tal tilknyttet hvert punkt i rummet (og tiden). Fra den klassiske fysik kendes f.eks. tyngdefelter og magnetfelter; ethvert sted omkring en masse eller en magnet har disse felter en størrelse og en retning. Kvantefelter er analoge hertil, men kvantiserede.
Så hvad er et atom egentlig? Vi ved det sådan set ikke. Fremfor at spørge hvad et atom er, giver det nok mere mening at spørge, hvordan det "virker" og opfører sig i forskellige sammenhænge. For at svare på dét, bygger vi bedre og bedre modeller, men det vil stadig altid bare være en model. Du kan læse mere om dét synspunkt i dette svar i min brevkasse.
Kredit: Peter Laursen.
Atomernes oprindelse
Nukleosyntese i Big Bang
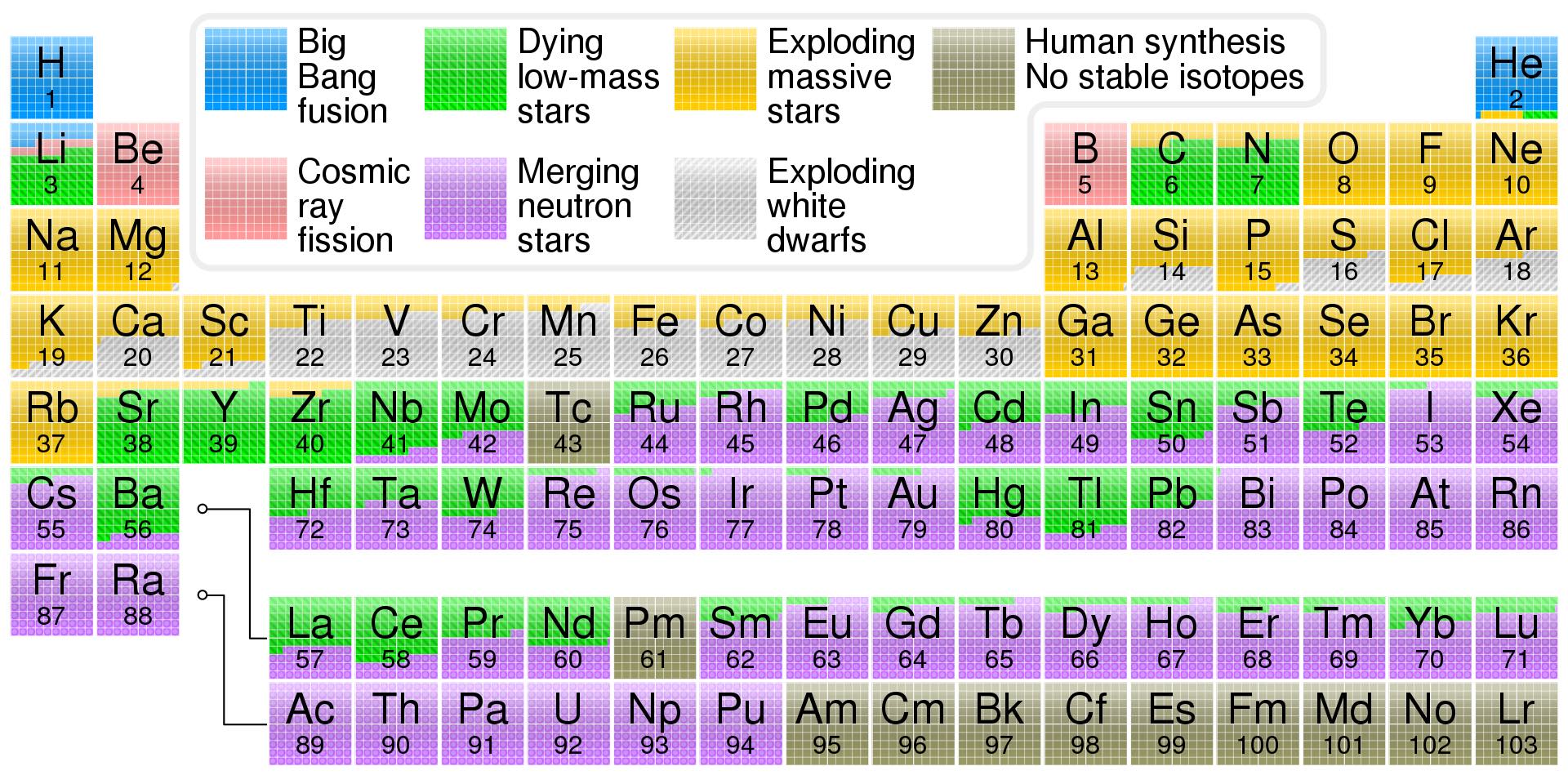
Uanset hvordan vi beskriver atomerne, består de altså af elektroner, protoner og neutroner, hvoraf de to sidste består af kvarker. Alle disse subatomare partikler er skabt i Big Bang. Kvarkerne kondenserede så at sige ud af den intense energitæthed, der eksisterede lige efter af "inflationen" havde pustet Universet op, omkring et picosekund efter Big Bang. Ekstremt energirige fotoner stødte sammen, og dannede elektronerne.
Som Universet udvidede sig, kølede det af, og partiklernes energi faldt tilsvarende. Efter et mikrosekund var energien lav nok til, at kvarkerne kunne samle sig og danne protoner og neutroner. På denne måde skabtes Universets letteste grundstof, hydrogen, som jo er det samme som en proton.
Tre minutter senere var Universet kølet ned til en milliard grader, hvilket er varmt nok til at protoner kan støde samme med nok kraft til at overvinde deres frastødning (da de jo alle er positive), og samtidig koldt nok til, at de nye atomkerner ikke straks går i stykker igen. Et kapløb satte ind mellem dannelsen af grundstoffer — eller nukleosyntese, som det kaldes — og den faldende temperatur, og efter et kvarters tid var det slut.
Resultatet var, at cirka 1/4 af al massen var blevet til det næstletteste grundstof, helium, mens mindre end en milliardtedel var blevet til det tredjeletteste, lithium. Tungere grundstoffer var der simpelthen stort set ikke.
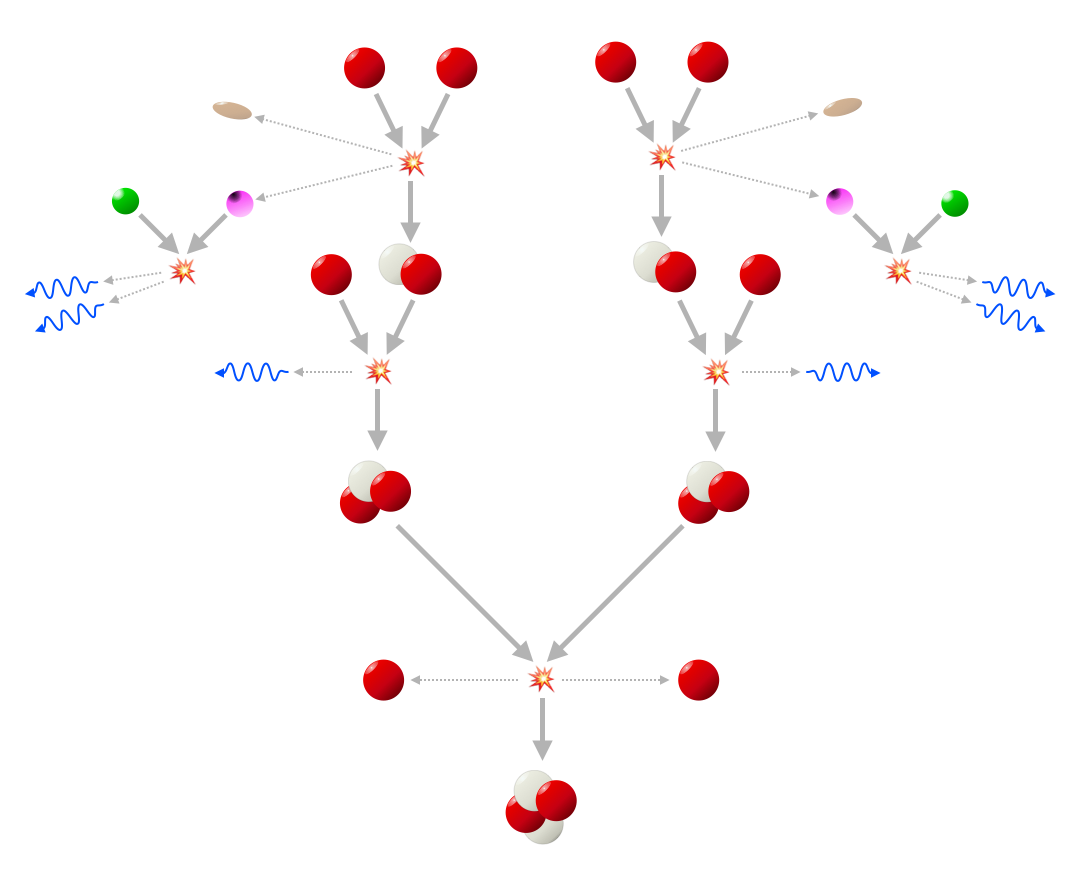
To protoner støder sammen, og den ene omdannes til en neutron under udsendelse af en positron (lilla), som er elektronens antipartikel, og en neutrino (brunlig). Positronen møder hurtigt en elektron som den annihilerer med og bliver til ren energi (dvs. to fotoner), mens neutrinoen stikker af. Resultatet er en speciel slags "tung" hydrogen (skrives 2H), også kaldet deuterium. Den smelter senere sammen med en anden proton under udsendelse af en foton, og skaber derved en slags "let" heliumkerne (skrives 3He). Denne 3He-kerne møder senere en anden 3He-kerne skabt på samme måde, som den fusionerer med, danner den "almindelige" helium 4He og spytter to overskydende protoner ud, som så kan begynde forfra. Nettoresultatet er altså, at fire protoner og to elektroner er blevet til én heliumkerne, to neutrinoer, og seks fotoner, som kan få en stjerne til at skinne.
Kredit: Peter Laursen.
Stjernerne står for resten
Atomerne der blev skabt burde egentlig kaldes ioner, som betyder "et atom, som ikke har lige så mange elektroner som protoner" (astronomer har det dog med at kalde begge dele atomer). I starten er der nemlig så varmt, at ethvert atom der prøver at samle sig straks vil blive ioniseret af en forbipasserende, højenergetisk foton. Først efter 380.000 år er temperaturen faldet nok til, at protoner og elektroner kan kombinere og danne neutrale atomer, og 100 millioner år senere har tyngdekraften fået Universets gas til at klumpe nok sammen til at danne stjerner.
De første stjerner består altså af ren hydrogen og helium (og en lille smule lithium). Stjerner lyser generelt, fordi de fusionerer hydrogen til helium, en proces der kræver høj temperatur og tryk, men som til gengæld giver energi. De største stjerner, som har højere tryk og temperatur, kan fusionere helium til tungere grundstoffer som kulstof, nitrogen og ilt.
Langsom og hurtig opbygning
Hen imod slutningen af deres liv, når stjernerne begynder at løbe tør for hydrogen i deres center, kan de fusionere heliumkerner til tungere og tungere grundstoffer. Men legen stopper ved jern, for herefter får man ikke energi ud af fusion; tværtimod kræver det energi. Lette stjerner svulmer op til røde kæmper, eller "AGB-stjerner", og i denne proces bygges langsomt tungere grundstoffer op ved at opsamle neutroner. Neutronerne kan så senere omdannes til en proton, hvorved atomet bliver til et nyt grundstof, et hak længere til højre i det periodiske system (ladning kan ikke opstå ud af ingenting, så der dannes også en elektron, og desuden noget der hedder en antineutrino for at få regnskabet til at gå helt op). Denne måde til opbygning af grundstoffer kaldes s-proces, hvor s'et står for "slow", da der går rundt regnet 10–100 år mellem hvert gang atomet fanger en neutron.
Men visse grundstoffer kan ikke bygges op på denne langsomme måde, da de når at gå i stykker igen gennem radioaktivt henfald. De kræver i stedet at kernerne beskydes med neutroner 100 gange i sekundet eller så, i den såkaldte r-proces (hvor r'et står for "rapid"). Sådan et bombardement kan finde sted når tunge stjerner ender deres liv i de gigantiske eksplosioner kendt som supernovaer. De tungeste stjerner kollapser og eksploderer "af sig selv", mens lettere stjerner dobbeltstjernesystemer først kan blive til en hvid dværg og dernæst langsomt opsamle gas fra sin kompagnon, indtil den til sidst får nok og eksploderer.
Kolliderende neutronstjerner
Indtil for relativt nyligt troede man at alle (naturlige) grundstoffer blev skabt på denne måde. Men i 2017 fandt man ud af, at en anden mekanisme dominerer dannelsen af henved halvdelen af alle tungere grundstoffer: Nogle supernova-eksplosioner efterlader en meget kompakt stjernerest, en såkaldt neutronstjerne. Hvis begge stjerner i et dobbeltstjernesystem bliver til neutronstjerner, fortsætter de deres kredsløb om hinanden. Men ved udsendelse af tyngdebølger mister de langsomt energi og nærmer sig derfor hinanden. Til sidst kolliderer de og eksploderer, og i denne proces skabes en masse tunge grundstoffer, bl.a. guld og platin.
Menneskeskabte grundstoffer
Bortset fra hydrogen har atomer generelt omtrent lige så mange neutroner som protoner. De kan så forekomme i lidt forskellige udgaver, eller isotoper, med et lidt forskelligt antal neutroner. Jo tungere atomkernerne er, jo mere ustabile har de med at være. Det betyder, at de er radioaktive, og efter noget tid henfalder til andre grundstoffer.
De tungeste elementer er så radioaktive — eller vejen til deres dannelse går gennem andre grundstoffer der er meget radioaktive eller på anden måde usandsynlige at opnå — at de ikke forekommer i naturen. Det har dog ikke afholdt os fra at få fingrene i dem, så i stedet har vi udvidet det periodiske system med efterhånden 24 syntetiske grundstoffer ved at hamre protoner ind i lettere grundstoffer i partikelacceleratorer (eller i atomkraftværker og -bomber).
Spallation
De eneste elementer, som ikke skabes på én af ovenstående måder, er de to lette grundstoffer beryllium og bor, som har hhv. 4 og 5 protoner i deres kerne. Disse to dannes i stedet ved at kosmiske stråler (dvs. højenergetiske partikler) smadrer ind i tungere atomkerner og får dem til at fissionere; en proces der kaldes "spallation".
Kredit: Cmglee/Wikimedia.
Mit yndlingsatom
Mit yndlingsatom er hydrogen. Det er simpelt nok til at jeg kan finde ud af at regne på det, det er det mest almindelige i Universet, og så kan det udsende Lyman α-fotoner.